Cơ sở tế bào và phân tử của ung thư
Nhanh lên! Chỉ còn 49 mặt hàng trong kho
00 days
21 hrs
40 mins
58 secs
CƠ SỞ TẾ BÀO VÀ PHÂN TỬ CỦA UNG THƯ
Động học tế bào
Thời gian nhân đôi là thời gian cần thiết để một tế bào hoàn thành một chu kỳ phân và tạo ra 2 tế bào mới.
Các tế bào ung thu, đặc biệt là những tế bào có nguồn gốc từ tủy xương hay hệ bạch huyết có thể có thời gian nhân đôi ngắn hơn và thường có tỷ lệ tế bào ở pha G0 (pha nghỉ) ít hơn.
Tế bào u ban đầu tăng sinh theo quy luật hàm số mũ sau đó đạt đến giới hạn khi số tế bào chết đi gần như tương đương với số tế bào mới sinh ra.
Tốc độ tăng sinh tế bào chậm dần có thể liên quan tới sự cạn kiệt chất dinh dưỡng và Oxygen vốn cần thiết cho sự tăng trưởng nhanh của khối u.
Các khối u nhỏ có tỷ lệ tế bào phân chia cao hơn so với khối u lớn.
Quần thể con các tế bào trong bệnh ung thư có các đặc tính của tế bào gốc.
Do đó các tế bào này có khả năng tăng sinh.
Chúng cũng ít chịu ảnh hưởng bởi với thuốc điều trị hoặc xạ trị.
Các tế bào khối u có khả năng hồi phục phát triển trở lại sau phẫu thuật, hóa trị và/hoặc xạ trị.
Động học tế bào của mỗi loại ung thư nhất định là một yếu tố quan trọng khi lên các phác đồ diều trị và có thể ảnh hưởng đến lịch dùng thuốc và khoảng thời gian giữa các đợt điều trị.
Nhiều loại thuốc chống ung thư, chẳng hạn như thuốc chống chuyển hóa, có hiệu quả nhất khi các tế bào đang ở giai đoạn phân chia mạnh.
Một số loại thuốc chỉ có tác dụng trong một giai đoạn cụ thể của chu kỳ tế bào và cần duy trì sử dụng trong thời gian dài để ngăn các tế bào phân chia trong giai đoạn nhạy cảm tối đa.
Tự phát triển và di căn của ung thư
Khi khối u phát triển, chất dinh dưỡng được cung cấp bởi sự khuếch tán trực tiếp từ hệ tuần hoàn.
Sự phát triển tại chỗ của khối u được tăng cường bởi các enzym (như enzym tiêu protein), có vai trò phá hủy mô xung quanh.
Khi số lượng tế bào ung thư tăng lên, thì các tế bào ung thư này có thể sản sinh các yếu tố hình thành mạch, chẳng hạn như yếu tố tăng trưởng nội mô mạch máu (VEGF), thúc đẩy sự phát triển của bệnh.
Ở giai đoạn đầu của bệnh, khối u có thể giải phóng các tế bào vào hệ tuần hoàn.
Từ mô hình động vật, người ta ước tính rằng với khối u 1cm có tới > 1 triệu tế bào u đi vào hệ tuần hoàn tĩnh mạch mỗi 24 giờ.
Các tế bào ung thư tuần hoàn được tìm thấy ở nhiều bệnh nhân bị ung thư giai đoạn tiến triển và thậm chí ở một số ung thư giai đoạn khu trú.
Mặc dù hầu hết các tế bào ung thư tuần hoàn sẽ chết đi, nhưng tế bào cơ hội có thể xâm nhập vào các mô, tạo ra di căn ở một vị trí xa.
Các khối u di căn phát triển giống như ung thư nguyên phát và sau đó có thể làm phát sinh các khối u di căn khác.
Hầu hết bệnh nhân ung thư chết vì di căn chứ không phải do ung thư nguyên phát.
Các thí nghiệm cho thấy khả năng xâm nhập, di chuyển, cấy ghép thành công và kích thích tăng sinh mạch máu tân tạo là các đặc tính quan trọng của tế bào di căn, giống như một tập con của tế bào u nguyên phát.
Hệ thống miễn dịch và ung thư
Trên bề mặt tế bào ung thư thường có các neoantigens mà hệ thống miễn dịch nhận dạng là "bất ngã", dẫn đến sự tấn công của hệ thống miễn dịch.
Khi nào và nếu cuộc tấn công miễn dịch này có hiệu quả, ung thư có thể không bao giờ phát triển.
Sự phá hủy các tế bào ung thư có thể được hoàn tất, trong trường hợp đó ung thư không bao giờ xuất hiện.
Tuy nhiên, một số tế bào ung thư có hoặc có khả năng tránh được sự phát hiện và/hoặc tiêu diệt của hệ thống miễn dịch, cho phép chúng tiếp tục nhân lên.
Hiện vẫn chưa rõ lý do tại sao suy giảm miễn dịch bẩm sinh hoặc mắc phải lại có nhiều khả năng phát triển các bệnh ung thư hiếm gặp như ung thư hắc tố da, ung thư biểu mô tế bào thận, u lympho mà không phải các bệnh ung thư phổ biến như ung thư phổi, vú, tuyến tiền liệt, đại tràng.
Hầu hết các bệnh ung thư trong đó hệ thống miễn dịch hoạt động không hiệu quả là do vi rút gây ra.
Dưới áp lực chọn lọc (ví dụ: tiến hóa), tế bào ung thư có thể đóng vai trò là các protein chốt kiểm soát miễn dịch.
Protein chốt kiểm soát miễn dịch là các phân tử bề mặt tế bào báo hiệu cho các tế bào T rằng tế bào mang chúng là bình thường và không nên bị tấn công.
Ví dụ: protein PD-L1, được nhận ra bởi phân tử PD-1 trên các tế bào T; khi PD-L1 liên kết với PD-1 trên tế bào T, sẽ ngăn chặn được đợt tấn công của miễn dịch.
Liệu pháp điều trị ung thư bằng cách sử dụng kháng thể đơn dòng gọi là chất ức chế chốt kiểm soát miễn dịch, ngăn chặn PD-L1 hoặc PD-1, cho phép hệ thống miễn dịch tấn công các tế bào ung thư được bảo vệ.
Protein liên kết với tế bào lympho T gây độc tế bào 4 (CTLA-4) là một protein điểm kiểm soát khác ngăn chặn sự tấn công của hệ miễn dịch và có thể bị một kháng thể đặc hiệu chặn theo cách tương tự.
Bởi vì các protein chốt kiểm soát miễn dịch có thể có mặt trên các tế bào bình thường, nên chất ức chế chốt kiểm soát miễn dịch cũng có thể tạo ra phản ứng tự miễn dịch.
Tế bào T biến đổi gen (gọi là liệu pháp tế bào T kháng thụ thể chimeric [CAR-T] cũng có thể được sử dụng trong liệu pháp miễn dịch.
Trong quá trình này, các tế bào T được lấy ra từ bệnh nhân và biến đổi gen để thể hiện các thụ thể có chứa một miền nhận diện cho một kháng nguyên cụ thể kết hợp với miền báo hiệu nội bào kích hoạt tế bào T.
Khi các tế bào T biến đổi được truyền vào, chúng có thể tấn công các tế bào mang kháng nguyên đích đó.
Thông thường, kháng nguyên đích chỉ đặc hiệu dòng dõi, không đặc hiệu đối với bệnh ung thư.
Liệu pháp tế bào T CAR-T có hiệu quả nhất đối với các bệnh ung thư tế bào B như bệnh bạch cầu nguyên bào lympho cấp tính tế bào B, u lympho tế bào B và u tủy tế bào plasma (đa u tủy).
Hiệu quả của liệu pháp tế bào CAR-T đối với các bệnh ung thư thể rắn thông thường vẫn chưa được xác định.
Bất thường phân tử
Các đột biến gen dẫn tới sự hình thành của các tế bào ung thư, do đó chúng xuất hiện trong tất cả các bệnh ung thư.
Những đột biến này làm thay đổi số lượng hoặc chức năng của các sản phẩm protein điều hòa sự tăng trưởng và phân chia tế bào và sửa chữa DNA.
Hai loại gen đột biến chính là
Gen sinh ung thư
Gen ức chế khối u
Gen sinh ung thư
Các gen sinh ung là dạng bất thường của gen bình thường (proto-oncogenes) điều chỉnh các khía cạnh khác nhau của sự phát triển và biệt hóa tế bào.
Đột biến các gen này gây ra kích thích trực tiếp và liên tục nhiều con đường dẫn truyền (ví dụ: các thụ thể yếu tố phát triển bề mặt tế bào, các con đường dẫn truyền tín hiệu tải nạp nội bào, các yếu tố sao chép, các yếu tố phát triển khác) kiểm soát sự tăng trưởng và phân chia tế bào, sửa chữa DNA, tăng sinh mạch và nhiều quá trình sinh lý học khác.
Có > 100 gen gây ung thư có thể góp phần vào sự chuyển dạng thành tế bào ung thư ở người.
Ví dụ, gen RAS mã hoá protein ras, mang tín hiệu từ các thụ thể gắn vào màng tế bào trên con đường RAS- MAPKinase tới nhân tế bào, điều hòa phân chia tế bào.
Các đột biến có thể dẫn đến sự hoạt hóa không thích hợp của protein ras, dẫn đến tăng trưởng tế bào không kiểm soát được.
Trên thực tế, protein ras bất thường gặp trong khoảng 25% các loại ung thư ở người.
Các gen sinh ung thư khác cũng được chỉ ra có liên quan đến các loại ung thư nhất định.
Bao gồm HER2 (khuếch đại trong ung thư vú và ung thư dạ dày và ít phổ biến hơn trong ung thư phổi)
BCR::ABL1 (gen thể khảm có trong bệnh bạch cầu mạn dòng tủy và một số bệnh bạch cầu cấp dòng lympho tế bào B)
CMYCC-MYC (u lympho Burkitt)
NMYCN-MYC (ung thư phổi tế bào nhỏ, u nguyên bào thần kinh)
EGFR (ung thư biểu mô tuyến của phổi)
EML4ALK (gen chimeric có trong ung thư biểu mô tuyến của phổi)
KRAS (ung thư tuyến tụy, ung thư phổi)
Các gen sinh ung thư đặc hiệu có thể có ý nghĩa quan trọng trong chẩn đoán, điều trị và tiên lượng .
Oncogenes thường là kết quả của
Các đột biến điểm tế bào soma (ví dụ, do các chất gây ung thư)
Sự khuếch đại gen (ví dụ, sự gia tăng số lượng bản sao của một gen bình thường)
Sự chuyển đoạn (trong đó các đoạn của các gen khác nhau hợp nhất thành một chuỗi duy nhất)
Những thay đổi này có thể làm tăng hoạt tính của sản phẩm gen (protein) hoặc thay đổi chức năng của nó. Đôi khi, sự đột biến của các gen trong tế bào mầm dẫn đến sự di truyền của một xu hướng ung thư.
Gen ức chế khối u
Các gen như TP53BRCA1 và BRCA2đóng vai trò trong sự phân chia tế bào bình thường và sửa chữa DNA, rất cần thiết trong phát hiện tín hiệu tăng trưởng bất thường hay tổn thương DNA của tế bào.
Nếu những gen này mất chức năng do đột biến di truyền hoặc đột biến mới, hệ thống theo dõi bắt cặp DNA bị mất hiệu quả, các tế bào có đột biến di truyền tự phát vẫn tồn tại và được nhân lên, cuối cùng hình thành khối u.
Giống như hầu hết các gen, có 2 alen mã hoá cho mỗi gen ức chế khối u.
Một allen bất thường của một gen có thể di truyền, dẫn đến cơ thể chỉ còn một allen còn chức năng của gen ức chế khối u.
Nếu đột biến xảy ra ở một allen còn lại này, cơ chế bảo vệ của gen ức chế khối u bình thường thứ hai này cũng mất đi.
Một protein điều hoà quan trọng khác, p53, có vai trò ngăn ngừa sự sao chép DNA bị tổn thương ở tế bào bình thường và thúc đẩy sự chết tế bào theo chương trình (apoptosis) ở tế bào có DNA bất thường.
Protein p53 bất hoạt hoặc bị thay đổi chức năng dẫn đến các tế bào có DNA bất thường tiếp tục sống sót và phân chia. TP53.
Các đột biến được di truyền cho các tế bào con, làm tăng nguy cơ sao chép DNA bất thường và hậu quả là sự chuyển dạng thành tế bào ung thư. TP53 bị khiếm khuyết trong nhiều bệnh ung thư ở người.
BRCA1 và BRCA2 các đột biến làm giảm chức năng làm tăng nguy cơ ung thư vú và ung thư buồng trứng.
Ví dụ, gen u nguyên bào võng mạc (RB) mã hoá protein Rb, có tác dụng điều hòa chu kỳ tế bào bằng cách dừng quá trình sao chép DNA.
Các đột biến trong họ gia đình gen RB xảy ra trong nhiều bệnh ung thư ở người, với các tế bào mang gen đột biến phân chia liên tục.
Giống như các gen sinh ung thư, đột biến gen ức chế khối u như TP53 hay RB ở các dòng tế bào trong các dòng tế bào sinh dục có thể di truyền và làm tăng nguy cơ ung thư ở thế hệ sau.
Bất thường nhiễm sắc thể
Có thể xảy ra thông qua đứt đoạn, hoán vị hoặc sao chép hoặc các cơ chế khác.
Nếu những biến đổi này làm hoạt hóa hay bất hoạt các gen mà dẫn đến tăng sự phân chia tế bào so với các tế bào bình thường, khi đó ung thư có thể phát triển.
Bất thường về nhiễm sắc thể xảy ra ở nhiều bệnh ung thư ở người.
Trong một số bệnh lý bẩm sinh (như hội chứng Bloom, thiếu máu Fanconi, hội chứng Down), quá trình sửa chữa DNA bị khiếm khuyết đứt gãy nhiễm sắc thể thường gặp, làm cho trẻ có nguy cơ cao mắc bệnh bạch cầu cấp và u lympho.
Các ảnh hưởng khác
Hầu hết các loại ung thư biểu mô có thể là kết quả của một chuỗi các đột biến dẫn đến sự chuyển đổi của tế bào ung thư.
Ví dụ, quá trình phát triển của ung thư đại tràng trong bệnh polyp có tính gia đình diễn ra thông qua một chuỗi các biến cố di truyền:
Tăng sinh biểu mô (mất gen ức chế trên nhiễm sắc thể 5), u tuyến giai đoạn đầu (thay đổi quá trình methyl hóa DNA), u tuyến giai đoạn trung gian (hoạt động quá mức của RAS gây ung thư), u tuyến giai đoạn muộn (mất gen ức chế trên nhiễm sắc thể 18) và cuối cùng là ung thư (mất gen trên nhiễm sắc thể 17). Các biến đổi di truyền tiếp theo có thể xảy ra để ung thư di căn.
Các đoạn đầu nhiễm sắc thể là các phức hợp nucleoprotein nằm ở đầu các đầu của nhiễm sắc thể giúp duy trì tính toàn vẹn của chúng.
Ở mô bình thường, các đoạn đầu nhiễm sắc thể này ngắn dần (trong quá trình lão hóa) nên sự phân chia tế bào chỉ có giới hạn.
Enzym telomerase, nếu được hoạt hoá trong tế bào khối u, hỗ trợ quá trình tổng hợp telomere mới và cho phép tăng sinh liên tục các tế bào bệnh ung thư.
Bất thường di truyền trong các gen chịu trách nhiệm tái tạo telomere dẫn đến telomere ngắn lại, làm tăng nguy cơ ung thư đối với da, đường tiêu hóa và tủy xương.
Yếu tố môi trường
Nhiễm trùng
Virus góp phần vào cơ chế bệnh sinh nhiều loại ung thư ở người.
Ung thư có thể xảy ra do sự tích hợp các yếu tố di truyền của virus vào DNA của người bệnh.
Những gen mới này được biểu hiện ở người bệnh;
Chúng có thể ảnh hưởng đến sự tăng trưởng hoặc phân chia tế bào hoặc phá vỡ các gen bình thường ở tế bào người bệnh vốn cần thiết để kiểm soát sự tăng trưởng và phân chia tế bào.
Ngoài ra, nhiễm virus có thể gây ra suy giảm miễn dịch, dẫn đến giảm kiểm soát miễn dịch đối với các khối u ở giai đoạn sớm. HIV làm tăng nguy cơ của nhiều loại ung thư.
Vi khuẩn cũng có thể gây ung thư.
Nhiễm Helicobacter pylori làm tăng nguy cơ một số loại ung thư (ung thư biểu mô tuyến dạ dày, u lympho ở dạ dày, u lympho liên kết niêm mạc (MALT).
Ký sinh trùng một số loại có thể dẫn đến ung thư.
Sán máng (Schistosoma haematobium) gây viêm mạn tính và xơ hóa bàng quang, có thể dẫn đến ung thư bàng quang.
Sán lá gan nhỏ (Opisthorchis sinensis) đã được chỉ ra có liên quan tới ung thư tụy và ung thư đường mật.
Phóng xạ
Tia cực tím có thể gây ra ung thư da (ví dụ: ung thư biểu mô tế bào đáy và ung thư biểu mô tế bào vảy, ung thư tế bào hắc tố) do gây tổn thương DNA.
Tổn thương DNA này bao gồm sự hình thành chất dimer thymidine gây ra tổn thương DNA, có thể ngăn cản quá trình cắt bỏ và tái tổng hợp chuỗi DNA bình thường.
Bệnh nhân vốn có các bất thường về sửa chữa DNA (ví dụ: xeroderma pigmentosum) hoặc suy giảm miễn dịch do thuốc hoặc bệnh lý nền dễ bị các khối u ác tính trên da do tiếp xúc với tia cực tím.
Bức xạ ion hoá cũng gây ung thư.
Ví dụ: những người sống sót sau vụ nổ bom nguyên tử ở Hiroshima và Nagasaki có tỷ lệ mắc bệnh bạch cầu và ung thư thể rắn cao hơn dự kiến.
Tương tự, xạ trị có thể gây ra bệnh bạch cầu, ung thư vú, sarcoma và một số ung thư tạng đặc khác nhiều năm sau đó.
Phơi nhiễm với tia X trong chẩn đoán hình ảnh được cho là làm tăng nguy cơ ung thư.
Phơi nhiễm nghề nghiệp (ví dụ: công nhân mỏ tiếp xúc với uranium) có liên quan đến sự phát triển của ung thư phổi, đặc biệt là ở những người hút thuốc.
Phơi nhiễm kéo dài với chiếu xạ nghề nghiệp hoặc lắng đọng chất thori dioxit trong cơ thể gây ra sarcom mạch và bệnh bạch cầu cấp dòng tuỷ.
Phơi nhiễm radon phóng xạ, được giải phóng từ đất, làm tăng nguy cơ ung thư phổi đặc biệt ở người hút thuốc.
Thông thường, radon phân tán nhanh chóng vào khí quyển và không gây hại.
Tuy nhiên, khi một tòa nhà được đặt trên đất có hàm lượng radon cao, radon có thể tích tụ, đôi khi tạo ra mức đủ cao trong không khí để gây hại.
Thuốc và hóa chất
Estrogen và progestin phối hợp trong thuốc ngừa thai đường uống có thể làm tăng nhẹ nguy cơ ung thư vú, nhưng nguy cơ này giảm theo thời gian.
Liệu pháp estrogen đơn thuần, không có progesterone, làm tăng nguy cơ ung thư tử cung.
Những rủi ro gia tăng này ở mức độ vừa phải.
Diethylstilbestrol (DES) làm tăng nguy cơ ung thư vú ở những phụ nữ dùng thuốc và tăng nguy cơ ung thư âm đạo ở con gái của những phụ nữ này đã dùng thuốc trước khi sinh.
Sử dụng lâu dài các steroid tổng hợp có thể làm tăng nguy cơ ung thư gan và tăng tốc ung thư tuyến tiền liệt.
Điều trị ung thư bằng hóa trị đơn thuần hay kết hợp với xạ trị làm tăng nguy cơ phát sinh ung thư thứ hai.
Các loại ung thư gia tăng phổ biến nhất do thuốc ức chế miễn dịch là ung thư da (bao gồm cả khối u ác tính), ung thư thận và u nguyên bào thần kinh.
Hydroxyurea làm tăng nguy cơ ung thư da do tiếp xúc với ánh nắng mặt trời, ngoài ra còn làm tăng nguy cơ mắc bệnh bạch cầu cấp tính ở những bệnh nhân bị rối loạn tăng sinh tủy (ví dụ, bệnh đa hồng cầu, tăng tiểu cầu) được điều trị lâu dài bằng hydroxyurea.
Hydroxyurea không chỉ gây mất đoạn 17p, dẫn đến mất alen TP53, nó còn làm suy giảm quá trình hoạt hóa TP53 ở những bệnh nhân bị rối loạn tăng sinh tủy.
Chất hóa học gây ung thư có thể gây đột biến gen và dẫn đến sự tăng sinh không kiểm soát và hình thành khối u.
Các chất khác, được gọi là hiệp đồng gây ung thư, có ít hoặc không có tiềm năng gây ung thư nhưng tăng cường khả năng gây ung thư của tác nhân khác khi phơi nhiễm đồng thời.
Các chất trong chế độ ăn
Một số chất được tiêu thụ trong chế độ ăn có thể làm tăng nguy cơ ung thư.
Ví dụ, một chế độ ăn nhiều chất béo có liên quan đến việc tăng nguy cơ ung thư ruột kết, vú và có thể là ung thư tuyến tiền liệt.
Những người uống nhiều rượu có nguy cơ cao mắc các bệnh ung thư khác nhau, bao gồm ung thư đầu cổ, gan và thực quản.
Chế độ ăn nhiều thức ăn hun khói, chế biến sẵn hoặc trong thịt nấu ở nhiệt độ cao làm tăng nguy cơ bị ung thư dạ dày.
Những người thừa cân hoặc béo phì có nguy cơ cao mắc nhiều loại ung thư, đặc biệt là ung thư vú, nội mạc tử cung, đại tràng, thận và thực quản.
Các yếu tố vật lý
Viêm da, phổi, đường tiêu hóa hoặc tuyến giáp mạn tính có thể dẫn đến sự tiến triển của ung thư.
Ví dụ, bệnh nhân bị viêm đại tràng mạn tính (viêm loét đại tràng) có nguy cơ cao bị ung thư đại trực tràng.
Tiếp xúc với ánh nắng mặt trời làm tăng nguy cơ ung thư da và ung thư hắc tố.
Rối loạn miễn dịch
Suy giảm chức năng hệ miễn dịch do đột biến gen di truyền, rối loạn mắc phải, lão hóa, hoặc thuốc ức chế miễn dịch làm ngăn cản sự kiểm soát miễn dịch bình thường với các khối u sớm và làm tăng tỷ lệ ung thư.
Các rối loạn miễn dịch liên quan đến ung thư được biết đến bao gồm
Chứng thất điều – giãn mạch (bệnh bạch cầu cấp dòng lympho [ALL], u não, ung thư dạ dày)
Hội chứng Wiskott-Aldrich (u lympho, bệnh bạch cầu cấp dòng lympho)
Bệnh thiếu gamma-globulin liên quan đến nhiễm sắc thể X (u lympho, bệnh bạch cầu cấp dòng lympho)
Suy giảm miễn dịch do thuốc ức chế miễn dịch hoặc nhiễm HIV (ung thư hạch bạch huyết, ung thư thận, u ác tính, ung thư cổ tử cung, ung thư đầu và cổ, sarcoma Kaposi)
Bệnh tự miễn dịch bao gồm lupus ban đỏ hệ thống, viêm khớp dạng thấp (RA) và hội chứng Sjogren (u lympho tế bào B)
CHẨN ĐOÁN UNG THƯ
Chẩn đoán bệnh ung thư có thể được nghĩ đến dựa trên bệnh sử và khám thực thể nhưng cần được xác định bằng sinh thiết làm mô bệnh học.
Đôi khi những gợi ý đầu tiên là kết quả xét nghiệm bất thường (ví dụ, thiếu máu do ung thư đại tràng).
Một bệnh sử hoàn chỉnh và khám lâm sàng có thể những dấu hiệu không mong đợi để chẩn đoán ung thư sớm.
Lịch sử
Các bác sĩ phải chú ý đến các yếu tố dễ mắc và phải hỏi cụ thể về tiền sử ung thư trong gia đình, tiền sử phơi nhiễm với môi trường (kể cả tiền sử hút thuốc), các bệnh đã mắc trước đây cũng như hiện tại (ví dụ: bệnh tự miễn, điều trị ức chế miễn dịch từ trước, viêm gan B hoặc viêm gan C, nhiễm HIV, xét nghiệm sàng lọc ung thư cổ tử cung bất thường, nhiễm vi-rút gây u nhú ở người).
Các triệu chứng cho thấy có thể là ung thư bao gồm
Mệt mỏi
Sụt cân
Sốt
Đổ mồ hôi đêm
Ho
Ho ra máu
Nôn ra máu
Đại tiện phân máu
Đại tiện ra máu
Đau kéo dài
Các triệu chứng khác có thể xuất hiện tùy thuộc vào vị trí của ung thư (ví dụ, khàn tiếng trong ung thư thanh quản hoặc chảy máu âm đạo bất thường trong ung thư tử cung).
Khám thực thể
Cần lưu ý đặc biệt đến da, hạch bạch huyết, phổi, vú, bụng và tinh hoàn.
Khám tuyến tiền liệt, trực tràng và âm đạo cũng rất quan trọng.
Kết quả khám giúp định hướng xét nghiệm thêm như chụp Xquang và sinh thiết.
Xét nghiệm
Các xét nghiệm bao gồm chẩn đoán bằng hình ảnh, các chất chỉ điểm u và sinh thiết;
Ít nhất một hoặc nhiều trong số xét nghiệm có thể được chỉ định ở những bệnh nhân có tiền sử nghi ngờ hoặc các phát hiện thực thể hoặc xét nghiệm.
Xét nghiệm bằng hình ảnh gồm chụp X-quang đơn giản, siêu âm, CT, chụp cắt lớp phát xạ positron (PET) và nghiên cứu MRI.
Các xét nghiệm này giúp xác định bất thường, xác định tính chất của tổn thương (dạng đặc hay nang), xác đinh kích thước và đưa ra mối liên quan với các cấu trúc xung quanh.
Những thông tin này có thể rất quan trọng nếu phải phẫu thuật hoặc sinh thiết.
Chất chỉ điểm u có thể cung cấp bằng chứng xác thực ở những bệnh nhân có kết quả gợi ý về một loại ung thư cụ thể.
Hầu hết các chất chỉ điểm u này không được chỉ định như xét nghiệm sàng lọc thường quy trừ ở bệnh nhân có nguy cơ cao. Một vài ví dụ hữu ích như:
Alpha-Fetoprotein:AFP(ung thư biểu mô tế bào gan, ung thư tinh hoàn).
CEA (ung thư đại tràng)
Beta-hCG (ung thư nguyên bào nuôi, ung thư biểu mô tinh hoàn)
Globulin miễn dịch trong huyết thanh (đa u tủy xương)
Xét nghiệm phân tử (các loại ung thư đa dạng)
CA 125 (ung thư buồng trứng)
CA 27-29 (ung thư vú)
PSA (Kháng nguyên ung thư đặc hiệu tuyến tiền liệt) – ung thư tuyến tiền liệt)
Một số chất chỉ điểm u dường như hữu ích nhất trong việc theo dõi đáp ứng với điều trị hơn là phát hiện khối u.
Sinh thiết để chẩn đoán xác định và đánh giá u nguyên phát hầu như luôn cần thiết khi nghi ngờ hoặc đã phát hiện ung thư.
Lựa chọn vị trí sinh thiết dựa trên khả năng tiếp cận và mức độ xâm lấn của u.
Nếu có nổi hạch, thì sinh thiết bằng kim nhỏ hoặc lõi có thể phát hiện được loại ung thư.
Sinh thiết lõi hoặc cắt bỏ hạch bạch huyết được khuyến khích để chẩn đoán u lympho vì bảo tồn cấu trúc nốt là quan trọng để chẩn đoán mô học chính xác.
Đôi khi cần phải sinh thiết niêm mạc.
Các con đường sinh thiết khác bao gồm nội soi phế quản hoặc nội soi trung thất để tìm các khối u phổi trung thất hoặc trung thất dễ tiếp cận, sinh thiết gan qua da nếu có tổn thương gan và sinh thiết phổi hoặc mô mềm có hướng dẫn bằng CT hoặc siêu âm.
Độ mô học là đánh giá mức độ phát triển của ung thư và cung cấp thông tin tiên lượng quan trọng.
Được xác định bằng cách kiểm tra mẫu mô.
Độ mô học được đánh giá chủ yếu dựa trên hình thái của các tế bào u, bao gồm sự xuất hiện của nhân, tế bào chất và nhân con; tần số phân bào và số lượng hoại tử.
Trong nhiều loại ung thư, các thang điểm độ mô học đã được xây dựng.
Xét nghiệm phân tử như phân tích nhiễm sắc thể, lai huỳnh quang tại chỗ (FISH), phản ứng khuyếch đại gen (PCR) và các kháng nguyên bề mặt tế bào (ví dụ như trong u lympho, bệnh bạch cầu, ung thư phổi và ung thư đại tràng) giúp tìm nguồn gốc nguyên phát của ung thư di căn đặc biệt là đối với ung thư chưa rõ nguyên phát và có thể hữu ích trong lựa chọn liệu pháp điều trị.
Phân giai đoạn
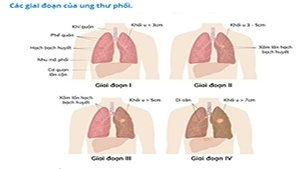
Một khi đã có chẩn đoán mô bệnh học, việc đánh giá giai đoạn xác định mức độ lan tràn của bệnh giúp lựa chọn điều trị và tiên lượng.
Đánh giá giai đoạn trên lâm sàng dựa trên các thông tin về bệnh sử, kết quả khám lâm sàng, chẩn đoán hình ảnh, xét nghiệm, sinh thiết tủy xương, sinh thiết hạch hay các vị trí nghi ngờ ung thư khác.
Phương pháp chẩn đoán hình ảnh
Các xét nghiệm chẩn đoán hình ảnh, đặc biệt là CT, PET và MRI, có thể phát hiện di căn đến não, phổi hoặc bụng, bao gồm tuyến thượng thận, các hạch bạch huyết sau phúc mạc, gan và lá lách.
MRI (có chất đối quang từ gadolinium) là thủ thuật được chỉ định để phát hiện và đánh giá u não, cả nguyên phát và thứ phát.
Chụp PET ngày càng được sử dụng rộng rãi để xác định hoạt động chuyển hóa của hạch hoặc khối u nghi ung thư.
Tích hợp PET-CT rất có giá trị, đặc biệt với ung thư phổi, ung thư vùng đầu cổ, ung thư vú và u lympho.
Siêu âm được sử dụng để đánh giá các khối u ở vú, buồng trứng, hốc mắt, tuyến giáp, tim, màng ngoài tim, gan, tụy, thận, tinh hoàn và sau phúc mạc.
Siêu âm cũng có thể giúp hướng dẫn sinh thiết qua da và phân biệt tổn thương dạng nang và dạng đặc.
Xạ hình có thể phát hiện một số loại di căn.
Xạ hình xương giúp đánh giá sự tái tạo xương bất thường (như hoạt động của tạo cốt bào) trước khi có thể phát hiện trên xquang.
Xạ hình xương này không hữu ích với các tổn thương ác tính chỉ gây phá hủy (như trong đa u tủy xương). Với những bệnh lý này, x quang thường quy được lựa chọn.
Xét nghiệm
Các chất và enzym trong huyết thanh cũng có thể giúp đánh giá giai đoạn ung thư.
Nồng độ men gan (phosphatase kiềm, lactate dehydrogenase, alanin aminotransferase) tăng cao và nồng độ bilirubin cao gợi ý di căn gan.
Tăng hoạt độ phosphatase kiềm và nồng độ Canxi huyết thanh có thể là bằng chứng đầu tiên của di căn xương.
Nồng độ nitơ urê hoặc creatinin trong máu tăng cao có thể cho thấy sự liên quan đến ung thư của thận, hệ thống thu thập hoặc bàng quang.
Nồng độ axit uric tăng cao thường xảy ra ở những bệnh nhân ung thư tăng sinh nhanh chóng và những bệnh nhân bị rối loạn tăng sinh tủy và tăng sinh bạch huyết.
Hầu hết những người có nồng độ axit uric tăng lên không bị ung thư.
Xét nghiệm xâm lấn
Nội soi trung thất đặc biệt có giá trị trong đánh giá giai đoạn của ung thư phổi không phải tế bào nhỏ.
Khi phát hiện có thương tổn hạch bạch huyết trung thất, bệnh nhân có thể có cải thiện bằng hóa trị liệu trước phẫu thuật và/hoặc xạ trị.
Chọc hút và sinh thiết tủy xương đặc biệt hữu ích trong việc phát hiện tổn thương do bệnh bạch cầu, u lympho và u tủy tương bào (đa u tủy) và di căn từ ung thư tế bào nhỏ phổi, ung thư vú và tuyến tiền liệt.
Sinh thiết tủy xương có thể có nhiều thông tin ở những bệnh nhân có bất thường huyết học không giải thích được (tức là thiếu máu, giảm tiểu cầu).
Sinh thiết các hạch bạch huyết khu vực trọng điểm là một phần của việc đánh giá nhiều bệnh ung thư, chẳng hạn như ung thư vú, tuyến giáp, dạ dày, phổi, ruột kết và ung thư hắc tố.
Cắt bỏ một hạch bạch huyết trọng điểm (được xác định bằng cách hấp thụ chất cản quang hoặc phóng xạ được tiêm vào khối ung thư) có thể cho phép lấy mẫu hạch bạch huyết hạn chế nhưng dứt điểm ở những bệnh nhân mắc các bệnh ung thư này.
SÀNG LỌC UNG THƯ
Đôi khi có thể phát hiện ung thư ở bệnh nhân không có triệu chứng gì nhờ khám lâm sàng định kỳ và thực hiện một số xét nghiệm sàng lọc.
Khám phát hiện ung thư tuyến giáp, khoang miệng, da, hạch bạch huyết, tinh hoàn, tuyến tiền liệt và buồng trứng nên được đưa vào nội dung khám sức khỏe thường quy.
Các xét nghiệm sang lọc là các xét nghiệm được thực hiện ở những bệnh nhân không có triệu chứng mà có nguy cơ.
Người ta sàng lọc ung thư vì chẩn đoán sớm có thể làm giảm tỷ lệ tử vong do bệnh bởi bệnh được chẩn đoán ở giai đoạn sớm có thể chữa khỏi.
Việc phát hiện sớm cũng giúp giảm việc phải dụng các liệu pháp điều trị mạnh và giảm chi phí.
Nguy cơ bao gồm kết quả dương tính giả, cần các xét nghiệm xác định lại và có thể gây lo lắng và tốn chi phí đáng kể (như sinh thiết, nội soi).
Bên cạnh đó là kết quả âm tính giả có dẫn đến cảm giác yên tâm sai lầm, khiến bệnh nhân bỏ qua các triệu chứng khác.
Việc sàng lọc ung thư nên được thực hiện trong những trường hợp sau:
Khi các nhóm nguy cơ cao riêng biệt có thể được xác định, chẳng hạn như những người có tiền sử gia đình mắc bệnh ung thư vú, buồng trứng, tuyến tụy, huyết học, đại tràng hoặc tuyến tiền liệt
Khi xét nghiệm sàng lọc được chứng minh là có lợi ích nhiều hơn rủi ro và được các cơ quan y tế khuyến cáo
Quy trình sàng lọc ở những người có nguy cơ trung bình* không có triệu chứng theo khuyến nghị của Hiệp hội Ung thư Hoa Kỳ (ACS), Lực lượng đặc nhiệm các dịch vụ phòng ngừa bệnh tật Hoa Kỳ (USPSTF) và Hiệp hội bác sĩ Hoa Kỳ (ACP)†
Động học tế bào
Thời gian nhân đôi là thời gian cần thiết để một tế bào hoàn thành một chu kỳ phân và tạo ra 2 tế bào mới.
Các tế bào ung thu, đặc biệt là những tế bào có nguồn gốc từ tủy xương hay hệ bạch huyết có thể có thời gian nhân đôi ngắn hơn và thường có tỷ lệ tế bào ở pha G0 (pha nghỉ) ít hơn.
Tế bào u ban đầu tăng sinh theo quy luật hàm số mũ sau đó đạt đến giới hạn khi số tế bào chết đi gần như tương đương với số tế bào mới sinh ra.
Tốc độ tăng sinh tế bào chậm dần có thể liên quan tới sự cạn kiệt chất dinh dưỡng và Oxygen vốn cần thiết cho sự tăng trưởng nhanh của khối u.
Các khối u nhỏ có tỷ lệ tế bào phân chia cao hơn so với khối u lớn.
Quần thể con các tế bào trong bệnh ung thư có các đặc tính của tế bào gốc.
Do đó các tế bào này có khả năng tăng sinh.
Chúng cũng ít chịu ảnh hưởng bởi với thuốc điều trị hoặc xạ trị.
Các tế bào khối u có khả năng hồi phục phát triển trở lại sau phẫu thuật, hóa trị và/hoặc xạ trị.
Động học tế bào của mỗi loại ung thư nhất định là một yếu tố quan trọng khi lên các phác đồ diều trị và có thể ảnh hưởng đến lịch dùng thuốc và khoảng thời gian giữa các đợt điều trị.
Nhiều loại thuốc chống ung thư, chẳng hạn như thuốc chống chuyển hóa, có hiệu quả nhất khi các tế bào đang ở giai đoạn phân chia mạnh.
Một số loại thuốc chỉ có tác dụng trong một giai đoạn cụ thể của chu kỳ tế bào và cần duy trì sử dụng trong thời gian dài để ngăn các tế bào phân chia trong giai đoạn nhạy cảm tối đa.
Tự phát triển và di căn của ung thư
Khi khối u phát triển, chất dinh dưỡng được cung cấp bởi sự khuếch tán trực tiếp từ hệ tuần hoàn.
Sự phát triển tại chỗ của khối u được tăng cường bởi các enzym (như enzym tiêu protein), có vai trò phá hủy mô xung quanh.
Khi số lượng tế bào ung thư tăng lên, thì các tế bào ung thư này có thể sản sinh các yếu tố hình thành mạch, chẳng hạn như yếu tố tăng trưởng nội mô mạch máu (VEGF), thúc đẩy sự phát triển của bệnh.
Ở giai đoạn đầu của bệnh, khối u có thể giải phóng các tế bào vào hệ tuần hoàn.
Từ mô hình động vật, người ta ước tính rằng với khối u 1cm có tới > 1 triệu tế bào u đi vào hệ tuần hoàn tĩnh mạch mỗi 24 giờ.
Các tế bào ung thư tuần hoàn được tìm thấy ở nhiều bệnh nhân bị ung thư giai đoạn tiến triển và thậm chí ở một số ung thư giai đoạn khu trú.
Mặc dù hầu hết các tế bào ung thư tuần hoàn sẽ chết đi, nhưng tế bào cơ hội có thể xâm nhập vào các mô, tạo ra di căn ở một vị trí xa.
Các khối u di căn phát triển giống như ung thư nguyên phát và sau đó có thể làm phát sinh các khối u di căn khác.
Hầu hết bệnh nhân ung thư chết vì di căn chứ không phải do ung thư nguyên phát.
Các thí nghiệm cho thấy khả năng xâm nhập, di chuyển, cấy ghép thành công và kích thích tăng sinh mạch máu tân tạo là các đặc tính quan trọng của tế bào di căn, giống như một tập con của tế bào u nguyên phát.
Hệ thống miễn dịch và ung thư
Trên bề mặt tế bào ung thư thường có các neoantigens mà hệ thống miễn dịch nhận dạng là "bất ngã", dẫn đến sự tấn công của hệ thống miễn dịch.
Khi nào và nếu cuộc tấn công miễn dịch này có hiệu quả, ung thư có thể không bao giờ phát triển.
Sự phá hủy các tế bào ung thư có thể được hoàn tất, trong trường hợp đó ung thư không bao giờ xuất hiện.
Tuy nhiên, một số tế bào ung thư có hoặc có khả năng tránh được sự phát hiện và/hoặc tiêu diệt của hệ thống miễn dịch, cho phép chúng tiếp tục nhân lên.
Hiện vẫn chưa rõ lý do tại sao suy giảm miễn dịch bẩm sinh hoặc mắc phải lại có nhiều khả năng phát triển các bệnh ung thư hiếm gặp như ung thư hắc tố da, ung thư biểu mô tế bào thận, u lympho mà không phải các bệnh ung thư phổ biến như ung thư phổi, vú, tuyến tiền liệt, đại tràng.
Hầu hết các bệnh ung thư trong đó hệ thống miễn dịch hoạt động không hiệu quả là do vi rút gây ra.
Dưới áp lực chọn lọc (ví dụ: tiến hóa), tế bào ung thư có thể đóng vai trò là các protein chốt kiểm soát miễn dịch.
Protein chốt kiểm soát miễn dịch là các phân tử bề mặt tế bào báo hiệu cho các tế bào T rằng tế bào mang chúng là bình thường và không nên bị tấn công.
Ví dụ: protein PD-L1, được nhận ra bởi phân tử PD-1 trên các tế bào T; khi PD-L1 liên kết với PD-1 trên tế bào T, sẽ ngăn chặn được đợt tấn công của miễn dịch.
Liệu pháp điều trị ung thư bằng cách sử dụng kháng thể đơn dòng gọi là chất ức chế chốt kiểm soát miễn dịch, ngăn chặn PD-L1 hoặc PD-1, cho phép hệ thống miễn dịch tấn công các tế bào ung thư được bảo vệ.
Protein liên kết với tế bào lympho T gây độc tế bào 4 (CTLA-4) là một protein điểm kiểm soát khác ngăn chặn sự tấn công của hệ miễn dịch và có thể bị một kháng thể đặc hiệu chặn theo cách tương tự.
Bởi vì các protein chốt kiểm soát miễn dịch có thể có mặt trên các tế bào bình thường, nên chất ức chế chốt kiểm soát miễn dịch cũng có thể tạo ra phản ứng tự miễn dịch.
Tế bào T biến đổi gen (gọi là liệu pháp tế bào T kháng thụ thể chimeric [CAR-T] cũng có thể được sử dụng trong liệu pháp miễn dịch.
Trong quá trình này, các tế bào T được lấy ra từ bệnh nhân và biến đổi gen để thể hiện các thụ thể có chứa một miền nhận diện cho một kháng nguyên cụ thể kết hợp với miền báo hiệu nội bào kích hoạt tế bào T.
Khi các tế bào T biến đổi được truyền vào, chúng có thể tấn công các tế bào mang kháng nguyên đích đó.
Thông thường, kháng nguyên đích chỉ đặc hiệu dòng dõi, không đặc hiệu đối với bệnh ung thư.
Liệu pháp tế bào T CAR-T có hiệu quả nhất đối với các bệnh ung thư tế bào B như bệnh bạch cầu nguyên bào lympho cấp tính tế bào B, u lympho tế bào B và u tủy tế bào plasma (đa u tủy).
Hiệu quả của liệu pháp tế bào CAR-T đối với các bệnh ung thư thể rắn thông thường vẫn chưa được xác định.
Bất thường phân tử
Các đột biến gen dẫn tới sự hình thành của các tế bào ung thư, do đó chúng xuất hiện trong tất cả các bệnh ung thư.
Những đột biến này làm thay đổi số lượng hoặc chức năng của các sản phẩm protein điều hòa sự tăng trưởng và phân chia tế bào và sửa chữa DNA.
Hai loại gen đột biến chính là
Gen sinh ung thư
Gen ức chế khối u
Gen sinh ung thư
Các gen sinh ung là dạng bất thường của gen bình thường (proto-oncogenes) điều chỉnh các khía cạnh khác nhau của sự phát triển và biệt hóa tế bào.
Đột biến các gen này gây ra kích thích trực tiếp và liên tục nhiều con đường dẫn truyền (ví dụ: các thụ thể yếu tố phát triển bề mặt tế bào, các con đường dẫn truyền tín hiệu tải nạp nội bào, các yếu tố sao chép, các yếu tố phát triển khác) kiểm soát sự tăng trưởng và phân chia tế bào, sửa chữa DNA, tăng sinh mạch và nhiều quá trình sinh lý học khác.
Có > 100 gen gây ung thư có thể góp phần vào sự chuyển dạng thành tế bào ung thư ở người.
Ví dụ, gen RAS mã hoá protein ras, mang tín hiệu từ các thụ thể gắn vào màng tế bào trên con đường RAS- MAPKinase tới nhân tế bào, điều hòa phân chia tế bào.
Các đột biến có thể dẫn đến sự hoạt hóa không thích hợp của protein ras, dẫn đến tăng trưởng tế bào không kiểm soát được.
Trên thực tế, protein ras bất thường gặp trong khoảng 25% các loại ung thư ở người.
Các gen sinh ung thư khác cũng được chỉ ra có liên quan đến các loại ung thư nhất định.
Bao gồm HER2 (khuếch đại trong ung thư vú và ung thư dạ dày và ít phổ biến hơn trong ung thư phổi)
BCR::ABL1 (gen thể khảm có trong bệnh bạch cầu mạn dòng tủy và một số bệnh bạch cầu cấp dòng lympho tế bào B)
CMYCC-MYC (u lympho Burkitt)
NMYCN-MYC (ung thư phổi tế bào nhỏ, u nguyên bào thần kinh)
EGFR (ung thư biểu mô tuyến của phổi)
EML4ALK (gen chimeric có trong ung thư biểu mô tuyến của phổi)
KRAS (ung thư tuyến tụy, ung thư phổi)
Các gen sinh ung thư đặc hiệu có thể có ý nghĩa quan trọng trong chẩn đoán, điều trị và tiên lượng .
Oncogenes thường là kết quả của
Các đột biến điểm tế bào soma (ví dụ, do các chất gây ung thư)
Sự khuếch đại gen (ví dụ, sự gia tăng số lượng bản sao của một gen bình thường)
Sự chuyển đoạn (trong đó các đoạn của các gen khác nhau hợp nhất thành một chuỗi duy nhất)
Những thay đổi này có thể làm tăng hoạt tính của sản phẩm gen (protein) hoặc thay đổi chức năng của nó. Đôi khi, sự đột biến của các gen trong tế bào mầm dẫn đến sự di truyền của một xu hướng ung thư.
Gen ức chế khối u
Các gen như TP53BRCA1 và BRCA2đóng vai trò trong sự phân chia tế bào bình thường và sửa chữa DNA, rất cần thiết trong phát hiện tín hiệu tăng trưởng bất thường hay tổn thương DNA của tế bào.
Nếu những gen này mất chức năng do đột biến di truyền hoặc đột biến mới, hệ thống theo dõi bắt cặp DNA bị mất hiệu quả, các tế bào có đột biến di truyền tự phát vẫn tồn tại và được nhân lên, cuối cùng hình thành khối u.
Giống như hầu hết các gen, có 2 alen mã hoá cho mỗi gen ức chế khối u.
Một allen bất thường của một gen có thể di truyền, dẫn đến cơ thể chỉ còn một allen còn chức năng của gen ức chế khối u.
Nếu đột biến xảy ra ở một allen còn lại này, cơ chế bảo vệ của gen ức chế khối u bình thường thứ hai này cũng mất đi.
Một protein điều hoà quan trọng khác, p53, có vai trò ngăn ngừa sự sao chép DNA bị tổn thương ở tế bào bình thường và thúc đẩy sự chết tế bào theo chương trình (apoptosis) ở tế bào có DNA bất thường.
Protein p53 bất hoạt hoặc bị thay đổi chức năng dẫn đến các tế bào có DNA bất thường tiếp tục sống sót và phân chia. TP53.
Các đột biến được di truyền cho các tế bào con, làm tăng nguy cơ sao chép DNA bất thường và hậu quả là sự chuyển dạng thành tế bào ung thư. TP53 bị khiếm khuyết trong nhiều bệnh ung thư ở người.
BRCA1 và BRCA2 các đột biến làm giảm chức năng làm tăng nguy cơ ung thư vú và ung thư buồng trứng.
Ví dụ, gen u nguyên bào võng mạc (RB) mã hoá protein Rb, có tác dụng điều hòa chu kỳ tế bào bằng cách dừng quá trình sao chép DNA.
Các đột biến trong họ gia đình gen RB xảy ra trong nhiều bệnh ung thư ở người, với các tế bào mang gen đột biến phân chia liên tục.
Giống như các gen sinh ung thư, đột biến gen ức chế khối u như TP53 hay RB ở các dòng tế bào trong các dòng tế bào sinh dục có thể di truyền và làm tăng nguy cơ ung thư ở thế hệ sau.
Bất thường nhiễm sắc thể
Có thể xảy ra thông qua đứt đoạn, hoán vị hoặc sao chép hoặc các cơ chế khác.
Nếu những biến đổi này làm hoạt hóa hay bất hoạt các gen mà dẫn đến tăng sự phân chia tế bào so với các tế bào bình thường, khi đó ung thư có thể phát triển.
Bất thường về nhiễm sắc thể xảy ra ở nhiều bệnh ung thư ở người.
Trong một số bệnh lý bẩm sinh (như hội chứng Bloom, thiếu máu Fanconi, hội chứng Down), quá trình sửa chữa DNA bị khiếm khuyết đứt gãy nhiễm sắc thể thường gặp, làm cho trẻ có nguy cơ cao mắc bệnh bạch cầu cấp và u lympho.
Các ảnh hưởng khác
Hầu hết các loại ung thư biểu mô có thể là kết quả của một chuỗi các đột biến dẫn đến sự chuyển đổi của tế bào ung thư.
Ví dụ, quá trình phát triển của ung thư đại tràng trong bệnh polyp có tính gia đình diễn ra thông qua một chuỗi các biến cố di truyền:
Tăng sinh biểu mô (mất gen ức chế trên nhiễm sắc thể 5), u tuyến giai đoạn đầu (thay đổi quá trình methyl hóa DNA), u tuyến giai đoạn trung gian (hoạt động quá mức của RAS gây ung thư), u tuyến giai đoạn muộn (mất gen ức chế trên nhiễm sắc thể 18) và cuối cùng là ung thư (mất gen trên nhiễm sắc thể 17). Các biến đổi di truyền tiếp theo có thể xảy ra để ung thư di căn.
Các đoạn đầu nhiễm sắc thể là các phức hợp nucleoprotein nằm ở đầu các đầu của nhiễm sắc thể giúp duy trì tính toàn vẹn của chúng.
Ở mô bình thường, các đoạn đầu nhiễm sắc thể này ngắn dần (trong quá trình lão hóa) nên sự phân chia tế bào chỉ có giới hạn.
Enzym telomerase, nếu được hoạt hoá trong tế bào khối u, hỗ trợ quá trình tổng hợp telomere mới và cho phép tăng sinh liên tục các tế bào bệnh ung thư.
Bất thường di truyền trong các gen chịu trách nhiệm tái tạo telomere dẫn đến telomere ngắn lại, làm tăng nguy cơ ung thư đối với da, đường tiêu hóa và tủy xương.
Yếu tố môi trường
Nhiễm trùng
Virus góp phần vào cơ chế bệnh sinh nhiều loại ung thư ở người.
Ung thư có thể xảy ra do sự tích hợp các yếu tố di truyền của virus vào DNA của người bệnh.
Những gen mới này được biểu hiện ở người bệnh;
Chúng có thể ảnh hưởng đến sự tăng trưởng hoặc phân chia tế bào hoặc phá vỡ các gen bình thường ở tế bào người bệnh vốn cần thiết để kiểm soát sự tăng trưởng và phân chia tế bào.
Ngoài ra, nhiễm virus có thể gây ra suy giảm miễn dịch, dẫn đến giảm kiểm soát miễn dịch đối với các khối u ở giai đoạn sớm. HIV làm tăng nguy cơ của nhiều loại ung thư.
Vi khuẩn cũng có thể gây ung thư.
Nhiễm Helicobacter pylori làm tăng nguy cơ một số loại ung thư (ung thư biểu mô tuyến dạ dày, u lympho ở dạ dày, u lympho liên kết niêm mạc (MALT).
Ký sinh trùng một số loại có thể dẫn đến ung thư.
Sán máng (Schistosoma haematobium) gây viêm mạn tính và xơ hóa bàng quang, có thể dẫn đến ung thư bàng quang.
Sán lá gan nhỏ (Opisthorchis sinensis) đã được chỉ ra có liên quan tới ung thư tụy và ung thư đường mật.
Phóng xạ
Tia cực tím có thể gây ra ung thư da (ví dụ: ung thư biểu mô tế bào đáy và ung thư biểu mô tế bào vảy, ung thư tế bào hắc tố) do gây tổn thương DNA.
Tổn thương DNA này bao gồm sự hình thành chất dimer thymidine gây ra tổn thương DNA, có thể ngăn cản quá trình cắt bỏ và tái tổng hợp chuỗi DNA bình thường.
Bệnh nhân vốn có các bất thường về sửa chữa DNA (ví dụ: xeroderma pigmentosum) hoặc suy giảm miễn dịch do thuốc hoặc bệnh lý nền dễ bị các khối u ác tính trên da do tiếp xúc với tia cực tím.
Bức xạ ion hoá cũng gây ung thư.
Ví dụ: những người sống sót sau vụ nổ bom nguyên tử ở Hiroshima và Nagasaki có tỷ lệ mắc bệnh bạch cầu và ung thư thể rắn cao hơn dự kiến.
Tương tự, xạ trị có thể gây ra bệnh bạch cầu, ung thư vú, sarcoma và một số ung thư tạng đặc khác nhiều năm sau đó.
Phơi nhiễm với tia X trong chẩn đoán hình ảnh được cho là làm tăng nguy cơ ung thư.
Phơi nhiễm nghề nghiệp (ví dụ: công nhân mỏ tiếp xúc với uranium) có liên quan đến sự phát triển của ung thư phổi, đặc biệt là ở những người hút thuốc.
Phơi nhiễm kéo dài với chiếu xạ nghề nghiệp hoặc lắng đọng chất thori dioxit trong cơ thể gây ra sarcom mạch và bệnh bạch cầu cấp dòng tuỷ.
Phơi nhiễm radon phóng xạ, được giải phóng từ đất, làm tăng nguy cơ ung thư phổi đặc biệt ở người hút thuốc.
Thông thường, radon phân tán nhanh chóng vào khí quyển và không gây hại.
Tuy nhiên, khi một tòa nhà được đặt trên đất có hàm lượng radon cao, radon có thể tích tụ, đôi khi tạo ra mức đủ cao trong không khí để gây hại.
Thuốc và hóa chất
Estrogen và progestin phối hợp trong thuốc ngừa thai đường uống có thể làm tăng nhẹ nguy cơ ung thư vú, nhưng nguy cơ này giảm theo thời gian.
Liệu pháp estrogen đơn thuần, không có progesterone, làm tăng nguy cơ ung thư tử cung.
Những rủi ro gia tăng này ở mức độ vừa phải.
Diethylstilbestrol (DES) làm tăng nguy cơ ung thư vú ở những phụ nữ dùng thuốc và tăng nguy cơ ung thư âm đạo ở con gái của những phụ nữ này đã dùng thuốc trước khi sinh.
Sử dụng lâu dài các steroid tổng hợp có thể làm tăng nguy cơ ung thư gan và tăng tốc ung thư tuyến tiền liệt.
Điều trị ung thư bằng hóa trị đơn thuần hay kết hợp với xạ trị làm tăng nguy cơ phát sinh ung thư thứ hai.
Các loại ung thư gia tăng phổ biến nhất do thuốc ức chế miễn dịch là ung thư da (bao gồm cả khối u ác tính), ung thư thận và u nguyên bào thần kinh.
Hydroxyurea làm tăng nguy cơ ung thư da do tiếp xúc với ánh nắng mặt trời, ngoài ra còn làm tăng nguy cơ mắc bệnh bạch cầu cấp tính ở những bệnh nhân bị rối loạn tăng sinh tủy (ví dụ, bệnh đa hồng cầu, tăng tiểu cầu) được điều trị lâu dài bằng hydroxyurea.
Hydroxyurea không chỉ gây mất đoạn 17p, dẫn đến mất alen TP53, nó còn làm suy giảm quá trình hoạt hóa TP53 ở những bệnh nhân bị rối loạn tăng sinh tủy.
Chất hóa học gây ung thư có thể gây đột biến gen và dẫn đến sự tăng sinh không kiểm soát và hình thành khối u.
Các chất khác, được gọi là hiệp đồng gây ung thư, có ít hoặc không có tiềm năng gây ung thư nhưng tăng cường khả năng gây ung thư của tác nhân khác khi phơi nhiễm đồng thời.
Các chất trong chế độ ăn
Một số chất được tiêu thụ trong chế độ ăn có thể làm tăng nguy cơ ung thư.
Ví dụ, một chế độ ăn nhiều chất béo có liên quan đến việc tăng nguy cơ ung thư ruột kết, vú và có thể là ung thư tuyến tiền liệt.
Những người uống nhiều rượu có nguy cơ cao mắc các bệnh ung thư khác nhau, bao gồm ung thư đầu cổ, gan và thực quản.
Chế độ ăn nhiều thức ăn hun khói, chế biến sẵn hoặc trong thịt nấu ở nhiệt độ cao làm tăng nguy cơ bị ung thư dạ dày.
Những người thừa cân hoặc béo phì có nguy cơ cao mắc nhiều loại ung thư, đặc biệt là ung thư vú, nội mạc tử cung, đại tràng, thận và thực quản.
Các yếu tố vật lý
Viêm da, phổi, đường tiêu hóa hoặc tuyến giáp mạn tính có thể dẫn đến sự tiến triển của ung thư.
Ví dụ, bệnh nhân bị viêm đại tràng mạn tính (viêm loét đại tràng) có nguy cơ cao bị ung thư đại trực tràng.
Tiếp xúc với ánh nắng mặt trời làm tăng nguy cơ ung thư da và ung thư hắc tố.
Rối loạn miễn dịch
Suy giảm chức năng hệ miễn dịch do đột biến gen di truyền, rối loạn mắc phải, lão hóa, hoặc thuốc ức chế miễn dịch làm ngăn cản sự kiểm soát miễn dịch bình thường với các khối u sớm và làm tăng tỷ lệ ung thư.
Các rối loạn miễn dịch liên quan đến ung thư được biết đến bao gồm
Chứng thất điều – giãn mạch (bệnh bạch cầu cấp dòng lympho [ALL], u não, ung thư dạ dày)
Hội chứng Wiskott-Aldrich (u lympho, bệnh bạch cầu cấp dòng lympho)
Bệnh thiếu gamma-globulin liên quan đến nhiễm sắc thể X (u lympho, bệnh bạch cầu cấp dòng lympho)
Suy giảm miễn dịch do thuốc ức chế miễn dịch hoặc nhiễm HIV (ung thư hạch bạch huyết, ung thư thận, u ác tính, ung thư cổ tử cung, ung thư đầu và cổ, sarcoma Kaposi)
Bệnh tự miễn dịch bao gồm lupus ban đỏ hệ thống, viêm khớp dạng thấp (RA) và hội chứng Sjogren (u lympho tế bào B)
CHẨN ĐOÁN UNG THƯ
Chẩn đoán bệnh ung thư có thể được nghĩ đến dựa trên bệnh sử và khám thực thể nhưng cần được xác định bằng sinh thiết làm mô bệnh học.
Đôi khi những gợi ý đầu tiên là kết quả xét nghiệm bất thường (ví dụ, thiếu máu do ung thư đại tràng).
Một bệnh sử hoàn chỉnh và khám lâm sàng có thể những dấu hiệu không mong đợi để chẩn đoán ung thư sớm.
Lịch sử
Các bác sĩ phải chú ý đến các yếu tố dễ mắc và phải hỏi cụ thể về tiền sử ung thư trong gia đình, tiền sử phơi nhiễm với môi trường (kể cả tiền sử hút thuốc), các bệnh đã mắc trước đây cũng như hiện tại (ví dụ: bệnh tự miễn, điều trị ức chế miễn dịch từ trước, viêm gan B hoặc viêm gan C, nhiễm HIV, xét nghiệm sàng lọc ung thư cổ tử cung bất thường, nhiễm vi-rút gây u nhú ở người).
Các triệu chứng cho thấy có thể là ung thư bao gồm
Mệt mỏi
Sụt cân
Sốt
Đổ mồ hôi đêm
Ho
Ho ra máu
Nôn ra máu
Đại tiện phân máu
Đại tiện ra máu
Đau kéo dài
Các triệu chứng khác có thể xuất hiện tùy thuộc vào vị trí của ung thư (ví dụ, khàn tiếng trong ung thư thanh quản hoặc chảy máu âm đạo bất thường trong ung thư tử cung).
Khám thực thể
Cần lưu ý đặc biệt đến da, hạch bạch huyết, phổi, vú, bụng và tinh hoàn.
Khám tuyến tiền liệt, trực tràng và âm đạo cũng rất quan trọng.
Kết quả khám giúp định hướng xét nghiệm thêm như chụp Xquang và sinh thiết.
Xét nghiệm
Các xét nghiệm bao gồm chẩn đoán bằng hình ảnh, các chất chỉ điểm u và sinh thiết;
Ít nhất một hoặc nhiều trong số xét nghiệm có thể được chỉ định ở những bệnh nhân có tiền sử nghi ngờ hoặc các phát hiện thực thể hoặc xét nghiệm.
Xét nghiệm bằng hình ảnh gồm chụp X-quang đơn giản, siêu âm, CT, chụp cắt lớp phát xạ positron (PET) và nghiên cứu MRI.
Các xét nghiệm này giúp xác định bất thường, xác định tính chất của tổn thương (dạng đặc hay nang), xác đinh kích thước và đưa ra mối liên quan với các cấu trúc xung quanh.
Những thông tin này có thể rất quan trọng nếu phải phẫu thuật hoặc sinh thiết.
Chất chỉ điểm u có thể cung cấp bằng chứng xác thực ở những bệnh nhân có kết quả gợi ý về một loại ung thư cụ thể.
Hầu hết các chất chỉ điểm u này không được chỉ định như xét nghiệm sàng lọc thường quy trừ ở bệnh nhân có nguy cơ cao. Một vài ví dụ hữu ích như:
Alpha-Fetoprotein:AFP(ung thư biểu mô tế bào gan, ung thư tinh hoàn).
CEA (ung thư đại tràng)
Beta-hCG (ung thư nguyên bào nuôi, ung thư biểu mô tinh hoàn)
Globulin miễn dịch trong huyết thanh (đa u tủy xương)
Xét nghiệm phân tử (các loại ung thư đa dạng)
CA 125 (ung thư buồng trứng)
CA 27-29 (ung thư vú)
PSA (Kháng nguyên ung thư đặc hiệu tuyến tiền liệt) – ung thư tuyến tiền liệt)
Một số chất chỉ điểm u dường như hữu ích nhất trong việc theo dõi đáp ứng với điều trị hơn là phát hiện khối u.
Sinh thiết để chẩn đoán xác định và đánh giá u nguyên phát hầu như luôn cần thiết khi nghi ngờ hoặc đã phát hiện ung thư.
Lựa chọn vị trí sinh thiết dựa trên khả năng tiếp cận và mức độ xâm lấn của u.
Nếu có nổi hạch, thì sinh thiết bằng kim nhỏ hoặc lõi có thể phát hiện được loại ung thư.
Sinh thiết lõi hoặc cắt bỏ hạch bạch huyết được khuyến khích để chẩn đoán u lympho vì bảo tồn cấu trúc nốt là quan trọng để chẩn đoán mô học chính xác.
Đôi khi cần phải sinh thiết niêm mạc.
Các con đường sinh thiết khác bao gồm nội soi phế quản hoặc nội soi trung thất để tìm các khối u phổi trung thất hoặc trung thất dễ tiếp cận, sinh thiết gan qua da nếu có tổn thương gan và sinh thiết phổi hoặc mô mềm có hướng dẫn bằng CT hoặc siêu âm.
Độ mô học là đánh giá mức độ phát triển của ung thư và cung cấp thông tin tiên lượng quan trọng.
Được xác định bằng cách kiểm tra mẫu mô.
Độ mô học được đánh giá chủ yếu dựa trên hình thái của các tế bào u, bao gồm sự xuất hiện của nhân, tế bào chất và nhân con; tần số phân bào và số lượng hoại tử.
Trong nhiều loại ung thư, các thang điểm độ mô học đã được xây dựng.
Xét nghiệm phân tử như phân tích nhiễm sắc thể, lai huỳnh quang tại chỗ (FISH), phản ứng khuyếch đại gen (PCR) và các kháng nguyên bề mặt tế bào (ví dụ như trong u lympho, bệnh bạch cầu, ung thư phổi và ung thư đại tràng) giúp tìm nguồn gốc nguyên phát của ung thư di căn đặc biệt là đối với ung thư chưa rõ nguyên phát và có thể hữu ích trong lựa chọn liệu pháp điều trị.
Phân giai đoạn
Một khi đã có chẩn đoán mô bệnh học, việc đánh giá giai đoạn xác định mức độ lan tràn của bệnh giúp lựa chọn điều trị và tiên lượng.
Đánh giá giai đoạn trên lâm sàng dựa trên các thông tin về bệnh sử, kết quả khám lâm sàng, chẩn đoán hình ảnh, xét nghiệm, sinh thiết tủy xương, sinh thiết hạch hay các vị trí nghi ngờ ung thư khác.
Phương pháp chẩn đoán hình ảnh
Các xét nghiệm chẩn đoán hình ảnh, đặc biệt là CT, PET và MRI, có thể phát hiện di căn đến não, phổi hoặc bụng, bao gồm tuyến thượng thận, các hạch bạch huyết sau phúc mạc, gan và lá lách.
MRI (có chất đối quang từ gadolinium) là thủ thuật được chỉ định để phát hiện và đánh giá u não, cả nguyên phát và thứ phát.
Chụp PET ngày càng được sử dụng rộng rãi để xác định hoạt động chuyển hóa của hạch hoặc khối u nghi ung thư.
Tích hợp PET-CT rất có giá trị, đặc biệt với ung thư phổi, ung thư vùng đầu cổ, ung thư vú và u lympho.
Siêu âm được sử dụng để đánh giá các khối u ở vú, buồng trứng, hốc mắt, tuyến giáp, tim, màng ngoài tim, gan, tụy, thận, tinh hoàn và sau phúc mạc.
Siêu âm cũng có thể giúp hướng dẫn sinh thiết qua da và phân biệt tổn thương dạng nang và dạng đặc.
Xạ hình có thể phát hiện một số loại di căn.
Xạ hình xương giúp đánh giá sự tái tạo xương bất thường (như hoạt động của tạo cốt bào) trước khi có thể phát hiện trên xquang.
Xạ hình xương này không hữu ích với các tổn thương ác tính chỉ gây phá hủy (như trong đa u tủy xương). Với những bệnh lý này, x quang thường quy được lựa chọn.
Xét nghiệm
Các chất và enzym trong huyết thanh cũng có thể giúp đánh giá giai đoạn ung thư.
Nồng độ men gan (phosphatase kiềm, lactate dehydrogenase, alanin aminotransferase) tăng cao và nồng độ bilirubin cao gợi ý di căn gan.
Tăng hoạt độ phosphatase kiềm và nồng độ Canxi huyết thanh có thể là bằng chứng đầu tiên của di căn xương.
Nồng độ nitơ urê hoặc creatinin trong máu tăng cao có thể cho thấy sự liên quan đến ung thư của thận, hệ thống thu thập hoặc bàng quang.
Nồng độ axit uric tăng cao thường xảy ra ở những bệnh nhân ung thư tăng sinh nhanh chóng và những bệnh nhân bị rối loạn tăng sinh tủy và tăng sinh bạch huyết.
Hầu hết những người có nồng độ axit uric tăng lên không bị ung thư.
Xét nghiệm xâm lấn
Nội soi trung thất đặc biệt có giá trị trong đánh giá giai đoạn của ung thư phổi không phải tế bào nhỏ.
Khi phát hiện có thương tổn hạch bạch huyết trung thất, bệnh nhân có thể có cải thiện bằng hóa trị liệu trước phẫu thuật và/hoặc xạ trị.
Chọc hút và sinh thiết tủy xương đặc biệt hữu ích trong việc phát hiện tổn thương do bệnh bạch cầu, u lympho và u tủy tương bào (đa u tủy) và di căn từ ung thư tế bào nhỏ phổi, ung thư vú và tuyến tiền liệt.
Sinh thiết tủy xương có thể có nhiều thông tin ở những bệnh nhân có bất thường huyết học không giải thích được (tức là thiếu máu, giảm tiểu cầu).
Sinh thiết các hạch bạch huyết khu vực trọng điểm là một phần của việc đánh giá nhiều bệnh ung thư, chẳng hạn như ung thư vú, tuyến giáp, dạ dày, phổi, ruột kết và ung thư hắc tố.
Cắt bỏ một hạch bạch huyết trọng điểm (được xác định bằng cách hấp thụ chất cản quang hoặc phóng xạ được tiêm vào khối ung thư) có thể cho phép lấy mẫu hạch bạch huyết hạn chế nhưng dứt điểm ở những bệnh nhân mắc các bệnh ung thư này.
SÀNG LỌC UNG THƯ
Đôi khi có thể phát hiện ung thư ở bệnh nhân không có triệu chứng gì nhờ khám lâm sàng định kỳ và thực hiện một số xét nghiệm sàng lọc.
Khám phát hiện ung thư tuyến giáp, khoang miệng, da, hạch bạch huyết, tinh hoàn, tuyến tiền liệt và buồng trứng nên được đưa vào nội dung khám sức khỏe thường quy.
Các xét nghiệm sang lọc là các xét nghiệm được thực hiện ở những bệnh nhân không có triệu chứng mà có nguy cơ.
Người ta sàng lọc ung thư vì chẩn đoán sớm có thể làm giảm tỷ lệ tử vong do bệnh bởi bệnh được chẩn đoán ở giai đoạn sớm có thể chữa khỏi.
Việc phát hiện sớm cũng giúp giảm việc phải dụng các liệu pháp điều trị mạnh và giảm chi phí.
Nguy cơ bao gồm kết quả dương tính giả, cần các xét nghiệm xác định lại và có thể gây lo lắng và tốn chi phí đáng kể (như sinh thiết, nội soi).
Bên cạnh đó là kết quả âm tính giả có dẫn đến cảm giác yên tâm sai lầm, khiến bệnh nhân bỏ qua các triệu chứng khác.
Việc sàng lọc ung thư nên được thực hiện trong những trường hợp sau:
Khi các nhóm nguy cơ cao riêng biệt có thể được xác định, chẳng hạn như những người có tiền sử gia đình mắc bệnh ung thư vú, buồng trứng, tuyến tụy, huyết học, đại tràng hoặc tuyến tiền liệt
Khi xét nghiệm sàng lọc được chứng minh là có lợi ích nhiều hơn rủi ro và được các cơ quan y tế khuyến cáo
Quy trình sàng lọc ở những người có nguy cơ trung bình* không có triệu chứng theo khuyến nghị của Hiệp hội Ung thư Hoa Kỳ (ACS), Lực lượng đặc nhiệm các dịch vụ phòng ngừa bệnh tật Hoa Kỳ (USPSTF) và Hiệp hội bác sĩ Hoa Kỳ (ACP)†
| Loại ung thư | Thủ thuật | Tần số |
| Ung thư vú | Chụp X-quang tuyến vú | ACS: Được đề xuất ở các độ tuổi sau: 40 đến 44: Tùy chọn 45 đến 54: Hàng năm ≥ 55: Từ 1 năm đến 2 năm một lần, liên tục miễn là người đó dự kiến sẽ sống ≥ 10 năm USPSTF: 2 năm một lần đối với phụ nữ từ 50 đến 74 tuổi ACP: Được đề xuất ở các độ tuổi sau: 40 đến 49: Không bắt buộc, sau khi thảo luận về lợi ích và tác hại tiềm ẩn (nhưng đối với hầu hết phụ nữ, tác hại lớn hơn lợi ích) 50 đến 74: 2 năm một lần ≥ 75 tuổi hoặc phụ nữ có tuổi thọ từ 10 năm trở xuống: Ngừng sàng lọc |
| Ung thư cổ tử cung | Xét nghiệm Papanicolaou (Pap) và/hoặc xét nghiệm vi rút u nhú ở người (HPV) | ACS: Được đề xuất ở các độ tuổi sau: < 25: Không xét nghiệm sàng lọc 25–65: Xét nghiệm HPV một mình 5 năm một lần hoặc xét nghiệm Pap cộng với xét nghiệm HPV 5 năm một lần hoặc xét nghiệm Pap 3 năm một lần > 65: Không cần kiểm tra nếu trước đó đã xét nghiệm và kết quả bình thường. USPSTF: Được đề xuất ở các độ tuổi sau: 21 đến 29: Xét nghiệm tế bào cổ tử cung đơn thuần 3 năm một lần 30 đến 65: Xét nghiệm tế bào cổ tử cung đơn thuần 3 năm một lần hoặc chỉ xét nghiệm vi-rút u nhú ở người (HPV) hoặc kết hợp với tế bào học (đồng xét nghiệm) 5 năm một lần. > 65: Không cần kiểm tra nếu trước đó đã xét nghiệm và kết quả bình thường. |
| Ung thư tuyến tiền liệt | Xét nghiệm máu tìm PSA (kháng nguyên đặc hiệu cho tuyến tiền liệt) | ACS: Vì lợi ích của việc tầm soát là không chắc chắn, bệnh nhân và bác sĩ nên thảo luận về những tác hại và lợi ích tiềm ẩn của việc tầm soát ung thư tuyến tiền liệt bắt đầu từ 50 tuổi (45 tuổi đối với người Mỹ gốc Phi hoặc những người có cha hoặc anh trai mắc bệnh ung thư tuyến tiền liệt trước 65 tuổi) USPSTF: Bệnh nhân và bác sĩ nên thảo luận về những tác hại và lợi ích tiềm ẩn của việc tầm soát ung thư tuyến tiền liệt bắt đầu từ tuổi 55, nhưng khuyến cáo không nên tầm soát ở tuổi 70 trở lên. |
| Ung thư đại trực tràng | Xét nghiệm phân: Xét nghiệm hóa miễn dịch trong phân (FIT), xét nghiệm máu ẩn trong phân guaiac có độ nhạy cao (gFOBT) hoặc xét nghiệm DNA trong phân đa mục tiêu hoặc là Nội soi đại tràng hoặc là Nội soi đại tràng sigma linh hoạt (có hoặc không có FIT định kỳ) hoặc là CT đại tràng |
ACS: Độ tuổi sàng lọc: Bắt đầu ở tuổi 45 và tiếp tục cho đến khi 75 tuổi; ở độ tuổi 76-85, khuyến nghị cá nhân hóa (ví dụ: dựa trên sức khỏe chung, tuổi thọ và sở thích của bệnh nhân) ACS: Xét nghiệm sàng lọc: FIT hoặc gFOBT hàng năm hoặc Xét nghiệm DNA phân đa mục tiêu, 3 năm một lần, hoặc Nội soi đại tràng 10 năm một lần, hoặc Chụp cắt lớp vi tính đại tràng hoặc nội soi đại tràng sigma linh hoạt 5 năm một lần USPSTF: Độ tuổi sàng lọc: 45 đến 75; cá nhân hóa cho độ tuổi từ 76 đến 85. USPSTF: Xét nghiệm sàng lọc: Giống như ACS, cũng như nội soi đại tràng sigma linh hoạt 10 năm một lần cộng với FIT hàng năm ACP: Độ tuổi: Dành cho độ tuổi từ 50 đến 75; không nên dùng cho tuổi> 75 hoặc tuổi thọ <10 năm ACP: Xét nghiệm sàng lọc: FIT hoặc gFOBT 2 năm một lần, hoặc Nội soi đại tràng 10 năm một lần, hoặc Nội soi đại tràng sigma linh hoạt 10 năm một lần cộng với xét nghiệm hóa chất miễn dịch trong phân 2 năm một lần |
| * Bệnh nhân có nguy cơ cao bị ung thư nhất định có thể cần phải được sàng lọc theo một lịch trình khác. Ví dụ, ACS khuyến cáo rằng bệnh nhân từ 55 đến 74 tuổi có nguy cơ cao bị ung thư phổi, chẳng hạn như những người hút thuốc có tiền sử 30 năm hút thuốc, đã hút thuốc trong 15 năm qua và những người có sức khỏe tốt, hãy kiểm tra định kỳ với CT liều thấp. USPSTF khuyến nghị tầm soát tương tự cho đến năm 80 tuổi. | ||
| † Khám ung thư tuyến giáp, khoang miệng, da, hạch bạch huyết, tinh hoàn và buồng trứng cũng nên được thực hiện trong quá trình chăm sóc y tế định kỳ. | ||
Chỉ những khách hàng đã đăng nhập và mua sản phẩm này mới có thể đưa ra đánh giá.
Danh mục:
Sách điều trị
Từ khóa:
Cơ sở tế bào và phân tử của ung thư






Đánh giá
Chưa có đánh giá nào.